염화 수소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염화 수소는 염소와 수소의 공유 결합으로 이루어진 화합물로, 물에 녹아 염산을 형성하며 강한 산성을 나타낸다. 물리적으로는 극성을 띠며 다양한 용매에 잘 녹고, 적외선 스펙트럼 분석을 통해 구조적 특성을 파악할 수 있다. 산업적으로는 염산 생산, 염화 비닐 및 알킬 할라이드 제조에 사용되며, 수소와 염소의 반응, 염화나트륨과 황산의 반응 등으로 얻을 수 있다. 역사적으로는 연금술에서 시작되어 르블랑법, 솔베이법 등을 거쳐 현재까지 다양한 산업 공정에 활용된다. 염화 수소는 부식성이 강하여 인체에 유해하며, 흡입 시 호흡기 손상, 피부 접촉 시 화상을 유발할 수 있어 취급에 주의가 필요하다.
더 읽어볼만한 페이지
- 수소 화합물 - 인산
인산은 화학식 H₃PO₄를 가지며, 인광석을 이용한 습식 또는 건식 공정으로 생산되어 비료, 식품 첨가물, 세제, 의약품, 금속 처리 등 다양한 산업 분야에 사용되는 인 화합물이다. - 수소 화합물 - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다. - 염화물 - 염산
염산은 염화수소 수용액으로, 자비르 이븐 하이얀에 의해 처음 발견되어 르블랑 공정을 통해 대량 생산되었으며, 현재는 유기 화합물 생산의 부산물로 얻어져 산업 전반에 사용되지만 강한 부식성으로 취급에 주의해야 하는 강산성 무기산이다. - 염화물 - 클로로포름
클로로포름은 화학식 CHCl3을 갖는 무색의 휘발성 액체 유기 화합물로, 마취 효과가 있어 과거에 마취제로 사용되었으나 독성 문제로 현재는 냉매 생산, 유기 용매 등으로 사용되며, 발암 가능성과 유독 물질 생성 위험으로 취급에 주의가 필요하고 사용을 줄이는 추세이다.
2. 물리적 성질
염화 수소는 염소 원자와 수소 원자의 강한 극성 공유 결합으로 이루어져 있어 물에 잘 용해되며, 그 수용액은 강산인 염산이다. 염산은 가장 널리 이용되는 강한 산 중 하나이다.[9] 메탄올, 에테르와 같은 다른 용매에도 잘 용해되며, 이 용액들도 여러 화학 반응에 대해 산-촉매 역할을 수행한다.
상온 상압 하에서 농도가 거의 25% 이상인 염산은 발연성이 있다.
2. 1. 구조 및 특성
염화 수소(HCl)는 염소 원자와 수소 원자가 공유 결합한 이원자 분자이다. 염소 원자의 전기음성도가 수소 원자보다 훨씬 커서 이 결합은 강한 극성을 띤다. 따라서 염화 수소 분자는 큰 쌍극자 모멘트를 가지며, 염소 원자에 부분적인 음전하(δ-)를, 수소 원자에 부분적인 양전하(δ+)를 띤다.[9]높은 극성 때문에 염화 수소는 물이나 메탄올과 같은 극성 용매에 매우 잘 녹는다. 물에 녹으면 히드로늄 이온(H3O+)과 염화물 이온(Cl-)을 생성하며, 이 수용액은 강산인 염산이다.[9] 염산의 산 해리 상수(''K''a)는 매우 커서 물 속에서 거의 완전히 해리된다. 물이 없는 환경에서도 염화 수소는 메탄올과 같은 용매에 녹아 산으로 작용할 수 있으며, 무수 조건이 필요한 화학 반응에서 산-촉매로 사용될 수 있다.
냉동된 염화 수소는 98,400에서 사방정계에서 입방정계로 결정 구조의 상전이를 겪는다. 두 구조 모두 염소 원자는 면심 입방 구조를 이룬다. 분광 및 유전 데이터 분석과 중수소 염화물(DCl) 구조 결정에 따르면, 고체 염화 수소는 HF와 유사하게 지그재그 사슬 형태로 배열된다.[10][11]
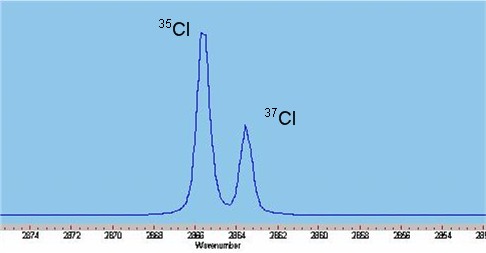
염화 수소 기체의 적외선 스펙트럼은 2886cm-1(파장 ~3.47um) 부근에 여러 개의 날카로운 흡수선이 모여 있는 형태로 나타난다. 상온에서 대부분의 분자는 바닥 진동 상태(''v'' = 0)에 존재한다. 분자의 진동-회전 전이를 보여주는 스펙트럼은 적외선 영역에서 관찰되며, 기체 셀이 있는 적외선 분광기를 사용하여 쉽게 측정할 수 있다.
자연 상태의 염소는 35Cl과 37Cl 두 가지 동위 원소로 구성되며, 약 3:1의 비율로 존재한다. 이 동위원소들의 환산 질량 차이로 인해 회전 에너지에 차이가 발생하고, 각 흡수선을 자세히 관찰하면 3:1 비율로 가중된 이중선이 나타난다.
2. 2. 용해도
염화 수소는 물뿐만 아니라 메탄올, 에테르 등 다양한 유기 용매에도 잘 용해된다.[12] 일반 용매에서 염화 수소의 용해도는 온도에 따라 달라진다.
염화 수소(HCl)는 물()과 가역적으로 반응하여 히드로늄 양이온()과 염화물 음이온()을 생성한다.[9]
3. 반응
:
이 반응의 결과로 생성된 용액은 염산이며, 강산이다. 염화 수소의 산 해리 상수(''K''a)는 매우 커서 물 속에서 거의 완전히 해리 또는 이온화된다는 것을 의미한다. 물이 없는 조건에서도 염화 수소는 메탄올과 같은 다른 용매에 용해되어 산으로 작용할 수 있다.
:
이처럼 염화 수소는 분자를 양성자화하거나 무수(물이 없는) 조건이 필요한 화학 반응에서 산-촉매 역할을 할 수 있다.
염화 수소 기체는 다음의 반응을 할 수 있다.
:
4. 제법
염화 수소는 염소와 수소를 직접 결합하여 생산할 수 있으며, 이 반응은 발열 반응이다. 생성된 염화 수소 기체는 물에 흡수되어 염산이 된다. 이때 사용되는 설비를 염산 로 또는 염산 버너라고 부른다.[13]
할로겐화 유기 화합물(예: 테플론, 프레온, CFC류, 클로로아세트산, PVC)의 생성 과정에서도 염화 수소가 부산물로 생성된다. 탄화수소의 수소 원자가 염소 원자로 치환되면서 방출된 수소 원자가 염소 분자의 다른 원자와 결합하여 염화 수소를 형성한다.
:RCl + HF → RF + HCl
생성된 염화 수소는 직접 재사용되거나 물에 흡수되어 산업용 염산으로 사용된다.[13]
자연에서는 화산 활동 등을 통해 염화 수소가 발생한다. 과거 르블랑법으로 탄산나트륨을 생산하던 시절에는 염화 수소 기체가 환경 문제를 일으키기도 했다.
4. 1. 만하임 공정
염화 나트륨과 황산을 반응시켜서 염화 수소를 얻는 방법으로, 만하임 공정이라고 부른다.[39]: 2 NaCl + H2SO4 → Na2SO4 + 2 HCl[39]
17세기, 독일 카를슈타트 암 마인(Karlstadt am Main) 출신의 요한 루돌프 글라우버는 염화나트륨과 황산을 사용해 황산 나트륨을 제조하는 과정에서 염화 수소를 얻었다. 1772년, 영국 리즈(Leeds) 출신의 조지프 프리스틀리는 순수한 염화수소를 제조했고, 1808년에는 영국 펜잔스(Penzance) 출신의 험프리 데이비가 염화 수소의 화학적 조성이 수소와 염소로 이루어져 있음을 증명했다.[39]
염화나트륨과 진한 황산의 반응으로도 염화 수소를 얻을 수 있다. 이 반응에서는 황산이 비휘발성이고 염화수소가 휘발성이라는 점이 중요하다.[39]
: NaCl + H2SO4 → NaHSO4 + HCl[39]
4. 2. 공업적 제법
공업적으로 염화 수소는 전기 분해에서 발생한 수소와 염소를 직접 반응시켜 얻는다.[40]: H2 + Cl2 = 2 HCl
이 반응은 발열 반응이므로, 설비를 염산 로 또는 염산 버너라고 부른다. 생성된 염화 수소 기체는 흡수되어 탈이온수에 흡수되면서 화학적으로 순수한 염산이 된다. 이 반응은 식품 산업 등에서 사용되는 매우 순수한 제품을 제공할 수 있다. 이 반응은 청색광에 의해서도 유발될 수 있다.[16]
염화 수소의 산업적 생산은 종종 염소화 및 불소화 유기 화합물(예: 테플론, 프레온, 기타 CFC류, 그리고 클로로아세트산 및 PVC)의 생성과 통합되어 있다. 종종 이러한 염산 생산은 현장에서의 자체 사용과 통합된다. 화학 반응에서, 탄화수소의 수소 원자는 염소 원자로 치환되며, 이때 방출된 수소 원자는 염소 분자의 여분의 원자와 재결합하여 염화 수소를 형성한다. 불소화는 후속적인 염소 치환 반응으로, 다시 염화 수소를 생성한다.
:RCl + HF → RF + HCl
생성된 염화 수소는 직접 재사용되거나 물에 흡수되어 기술 등급 또는 산업 등급의 염산이 된다.
염화 나트륨 수용액의 전기분해에 의해 수산화 나트륨과 함께 수소와 염소를 생성하고, 그 후 수소와 염소를 혼합하여 만들기도 한다(이온교환막법). 최근에는 염화 비닐, 염화 비닐리덴 등의 제조 부산물로 회수되는 염화 수소의 생산량이 더 많다.
: RCl + HCl (R: 알킬기, 비닐기 등)
2012년도 일본 국내 염화 수소 가스(염산 분은 제외) 생산량은 98,401톤, 소비량은 92,939톤이다.[31]
4. 3. 실험실 제법
진한 염산을 황산 또는 무수 염화칼슘으로 탈수하여 염화 수소 기체를 발생시킬 수 있다. 이를 위해 'HCl 발생기'를 사용한다.[17] 또는 황산과 염화 나트륨의 반응으로도 염화 수소를 생성할 수 있다.[17]:NaCl + H2SO4 → NaHSO₄ + HCl↑
이 반응은 상온에서 일어나며, 발생기 안에 염화 나트륨이 남아있고 200°C 이상 가열하면 반응이 더 진행된다.
:NaCl + NaHSO₄ → Na₂SO₄ + HCl↑
이러한 발생기가 작동하려면 시약이 건조해야 한다.
인화물, 염화티오닐 (SOCl₂), 아실 클로라이드와 같은 특정 반응성 염화물의 가수분해를 통해서도 염화 수소를 제조할 수 있다. 예를 들어, 차가운 물을 오염화인 (PCl₅)에 서서히 적하하여 HCl을 얻을 수 있다.
:PCl₅ + H₂O → POCl₃ + 2 HCl↑
5. 역사
900년경, 자비르 이븐 하이얀(Jabir ibn Hayyan, 라틴어: Geber)의 저서로 여겨지는 아랍어 저술과 페르시아의 의사이자 연금술사인 아부 바크르 알라지(Abu Bakr al-Razi, 약 865~925년, 라틴어: Rhazes)는 염화 암모늄을 감청(vitriol)과 함께 증류하는 실험을 통해 염화 수소를 생성했다.[19] 알라지는 실험 중 원시적인 염산 생산 방법을 우연히 발견했을 가능성이 있다.[20] 하지만 초기의 염화물 염 실험에서는 기체 생성물이 대부분 버려졌고, 염화 수소의 화학적 용도가 발견되기 전에 여러 번 생성되었을 가능성이 높다.[21]
염화수은(II)(승홍) 합성은 그러한 초기 활용 사례 중 하나였다. 수은을 명반과 염화암모늄 또는 감청과 염화나트륨과 함께 가열하여 생산하는 방법은 11세기 또는 12세기 아랍어 저술인 "명반과 염에 관하여"(De aluminibus et salibus)에 처음 기술되었는데, 이는 잘못 아부 바크르 알라지의 저술로 여겨지며, 제라르드 크레모나(Gerard of Cremona, 1144~1187)에 의해 라틴어로 번역되었다.[22]
1300년 이후, 가짜 게베르(pseudo-Geber)는 "진실의 발견에 관하여"(De inventione veritatis)에서 염화암모늄을 질산에 첨가하면 금을 용해할 수 있는 강력한 용매인 왕수를 생산할 수 있다는 것을 발견했다.[23]
16세기 후반, 혼합되지 않은 염산을 제조하는 방법이 발견된 후,[24] 이 새로운 산(당시에는 "소금의 정신" 또는 "acidum salis"로 알려짐)이 "바닷물 산성 공기"라고 불리는 기체 상태의 염화수소를 방출한다는 것이 인식되었다.
17세기, 독일 카를슈타트 암 마인(Karlstadt am Main, Germany) 출신의 요한 루돌프 글라우버(Johann Rudolf Glauber)는 염화나트륨과 황산을 사용하여 황산나트륨을 제조하는 만하임 공정(Mannheim process) 과정에서 염화수소를 얻었다. 1772년, 칼 빌헬름 셸레(Carl Wilhelm Scheele)도 이 반응을 보고했으며, 때때로 그 발견의 공로를 인정받는다. 1772년, 영국 리즈(Leeds, England) 출신의 조지프 프리스틀리(Joseph Priestley)는 순수한 염화수소를 제조했고, 1810년 영국 펜잔스(Penzance, England) 출신의 험프리 데이비(Humphry Davy)는 그것이 수소와 염소로 구성되어 있다는 것을 밝혔다.[25]
산업혁명 동안 탄산나트륨과 같은 알칼리성 물질에 대한 수요가 증가했고, 니콜라 르블랑(Nicolas Leblanc)은 르블랑법을 개발하여 탄산나트륨을 산업 규모로 생산했다. 르블랑법에서는 황산, 석회석, 석탄을 사용하여 염을 탄산나트륨으로 전환하는데, 이 과정에서 염화수소가 부산물로 생성되었다. 처음에는 이 기체가 대기 중으로 배출되었지만, 1863년 알칼리법에 따라 그러한 배출이 금지되었고, 탄산나트륨 생산업체는 물에 HCl 폐가스를 흡수하여 산업 규모로 염산을 생산했다.
이후 하그리브스법이 개발되었는데, 이는 황산 대신 이산화황, 물, 공기를 사용한다는 점을 제외하고는 르블랑법과 유사하며 전반적으로 발열 반응이다. 20세기 초, 르블랑법은 HCl을 생성하지 않는 솔베이법으로 대체되었다. 그러나 염산 생산 과정에서 염화수소 생산은 계속되었다.
20세기 염화수소의 역사적 용도에는 클로로프렌과 염화비닐을 생산하기 위한 알킨의 염화수소화가 포함된다. 이들은 차례로 중합되어 각각 폴리클로로프렌(네오프렌)과 폴리염화비닐(PVC)을 만든다. 염화비닐 생산에서는 아세틸렌에 HCl을 첨가하여 분자의 삼중 결합에 걸쳐 염화수소화하여 삼중 결합을 이중 결합으로 바꾸어 염화비닐을 생성한다.
1960년대까지 클로로프렌을 만드는 데 사용되었던 "아세틸렌 공정"은 두 개의 아세틸렌 분자를 결합한 다음, 결합된 중간체에 HCl을 첨가하여 삼중 결합을 클로로프렌으로 변환하는 것으로 시작한다.
이 "아세틸렌 공정"은 에틸렌의 이중 결합에 염소를 첨가하는 공정으로 대체되었으며, 그 후 제거 반응으로 HCl과 클로로프렌이 생성된다.
염화수소는 수소와 염소의 반응으로 얻을 수 있다.
:
혹은 염화나트륨과 진한 황산의 반응으로 얻을 수 있다. 이 반응에서는 황산이 비휘발성이고 염화수소가 휘발성이라는 점이 중요하다.
:
염화나트륨 + 진한 황산 → 황산수소나트륨 + 염화수소
공업적으로는 염화나트륨 수용액의 전기분해에 의해 수산화나트륨과 함께 수소와 염소를 생성하고, 그 후 수소와 염소를 혼합하여 만든다(이온교환막법). 최근에는 다음 반응과 같이 염화비닐이나 염화비닐리덴 등의 제조 부산물로 회수되는 염화수소의 생산량이 더 많다.
:
(R: 알킬기, 비닐기 등)
염화수소 가스(염산 분은 제외)의 2012년도 일본 국내 생산량은 98,401톤, 소비량은 92,939톤이다.[31]
자연에서는 화산 활동 등으로 발생한다. 르블랑법이 탄산나트륨(탄산소다) 생성의 주요 방법이었던 시대에는 이 기체가 문제가 되었다.
6. 용도
대부분의 염화 수소는 염산 생산에 사용된다. 또한 염화비닐과 많은 알킬 할라이드 생산에도 사용된다.[13] 트리클로로실란은 약 300°C에서 염화 수소와 실리콘의 반응으로 생성되는 초고순도 실리콘의 전구체이다.[18]
염화 수소는 염화나트륨 수용액의 전기분해를 통해 수산화나트륨과 함께 수소와 염소를 생성하고, 그 후 수소와 염소를 혼합하여 만들기도 한다(이온교환막법). 최근에는 염화비닐이나 염화비닐리덴 등의 제조 부산물로 회수되는 염화 수소의 생산량이 더 많다.
2012년도 일본의 염화 수소 가스(염산 분은 제외) 생산량은 98,401톤, 소비량은 92,939톤이다.[31]
7. 안전성
염화 수소는 체내 조직의 수분과 접촉하면 부식성 염산을 형성한다. 증기를 흡입하면 기침, 질식, 코와 목 및 상부 호흡기의 염증을 유발할 수 있으며, 심한 경우 폐부종, 순환계 기능 부전 및 사망에 이를 수 있다.[26] 피부 접촉은 발적, 통증 및 심각한 화상을 유발할 수 있다. 염화 수소는 눈에 심한 화상을 입히고 영구적인 눈 손상을 초래할 수 있다.
미국 직업안전보건청(Occupational Safety and Health Administration)과 국립 직업안전보건연구소(National Institute for Occupational Safety and Health)는 염화 수소에 대한 직업적 노출 한계를 5 ppm (7mg/m3)로 설정하였고,[27] 염화 수소 작업장 안전 문제에 대한 광범위한 정보를 수집하였다.[28]
대한민국에서는 「유해화학물질관리법」에 따라, 원체 및 일정 농도 이상의 제제가 위험물로 지정되어 있다.
랫드의 흡입 독성에서 LC50은 3,124 ppm/1h이다.
참조
[1]
웹사이트
hydrogen chloride (CHEBI:17883)
https://www.ebi.ac.u[...]
European Bioinformatics Institute
[2]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
Royal Society of Chemistry
2014
[3]
문서
CRC91
[4]
웹사이트
Hydrogen Chloride
http://encyclopedia.[...]
Air Liquide
[5]
서적
https://books.google[...]
Cambridge University Press
2004
[6]
논문
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
[7]
문서
PGCH
[8]
문서
Hydrogen chloride
[9]
서적
Principles of Organic Chemistry
https://books.google[...]
Elsevier Science
2015
[10]
논문
Struttura e polimorfismo degli acidi alogenidrici
[11]
논문
Crystal Structure of Solid Hydrogen Chloride and Deuterium Chloride
[12]
웹사이트
Hydrochloric Acid – Compound Summary
https://pubchem.ncbi[...]
[13]
서적
Hydrochloric Acid
[14]
논문
Observations on different kinds of air [i.e., gases]
https://books.google[...]
[15]
논문
Electro-chemical researches, on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia
https://books.google[...]
[16]
영상매체
Hydrogen Chloride Cannon
https://www.youtube.[...]
[17]
논문
A Convenient Way To Generate Hydrogen Chloride in the Freshman Lab
http://jchemed.chem.[...]
2009-05-06
[18]
서적
Ullmann's Encyclopedia of Industrial Chemistry
[19]
서적
Jâbir ibn Hayyân: Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque
Institut Français d'Archéologie Orientale
[20]
서적
The Alchemy of Al-Razi: A Translation of the "Book of Secrets"
CreateSpace Independent Publishing Platform
2015
[21]
서적
The Origins of Chemistry
[22]
서적
The Origins of Chemistry
[23]
논문
Vitriol in the History of Chemistry
http://www.chemicke-[...]
[24]
서적
The Origins of Chemistry
[25]
논문
The Wilkins Lecture. Sir Humphry Davy, Bt., P.R.S. 1778–1829
[26]
웹사이트
Hydrogen Chloride
https://www.ncbi.nlm[...]
National Academies Press (US)
2009-00-00
[27]
웹사이트
CDC – NIOSH Pocket Guide to Chemical Hazards
https://www.cdc.gov/[...]
[28]
웹사이트
Hydrogen Chloride
https://www.cdc.gov/[...]
2012-03-05
[29]
웹사이트
Hydrogen chloride
https://webbook.nist[...]
NIST
[30]
웹사이트
厚生労働省モデルSDS
https://anzeninfo.mh[...]
[31]
웹사이트
経済産業省生産動態統計年報 化学工業統計編
https://www.meti.go.[...]
[32]
웹인용
hydrogen chloride (CHEBI:17883)
https://www.ebi.ac.u[...]
European Bioinformatics Institute
[33]
문서
CRC91
[34]
웹사이트
Hydrogen Chloride
http://encyclopedia.[...]
Air Liquide
[35]
서적
https://books.google[...]
Cambridge University Press
2004
[36]
논문
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
[37]
문서 #추가적인 정보 없이 PGCH만으로는 유형을 특정할 수 없음.
PGCH
[38]
문서 # 추가적인 정보 없이 IDLH만으로는 유형을 특정할 수 없음.
Hydrogen chloride
[39]
서적
Riegel's Handbook of Industrial Chemistry
http://books.google.[...]
[40]
서적
완자 화학I 2권
비상
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com